Fluorescence Resonance Energy Transfer (FRET)
Fluoreszenz Resonanz Energie Transfert (FRET) ass en net-stralungsenergie Transfermaart Prozess an deem d'Spender opgereegt Staat Energie duerch d'Interaktioun vun intermolecular elektresch Koppelen un den Akzeptor opgereegt Staat transferéierte gëtt.Dëse Prozess beinhalt keng Photonen an ass dofir net-stralung.Dësen Assay huet d'Virdeeler séier, sensibel an einfach ze sinn.
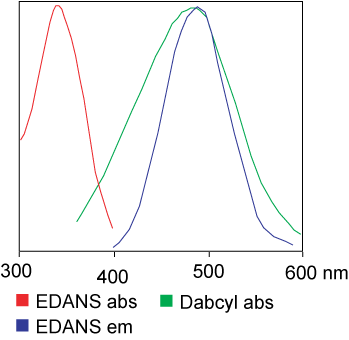
D'Faarf, déi am FRET Assay benotzt gëtt, kann identesch sinn.Awer an de meeschte Applikatiounen gi verschidde Faarwen tatsächlech benotzt.Kuerz gesot, den Transfer vun der Liichtresonanzenergie ass den Transfer vun engem Paar Dipole vum Spender (Faarf 1) an den Akzeptor (Faarf 2) wann d'Spendergrupp opgereegt ass.Am Allgemengen iwwerlappt den Emissiounsspektrum vun der Donor Fluorophoregrupp mam Absorptiounsspektrum vun der Acceptor Grupp."Wann d'Distanz tëscht den zwee Fluorophore passend ass (10 - 100 A), kann den Transfer vun der Fluorophorenergie vum Spender op den Akzeptor observéiert ginn."D'Method vum Energietransfer hänkt vun der chemescher Struktur vum Rezeptor of:
1. Gëtt a molekulare Schwéngung ëmgewandelt, dat heescht, d'Liicht vum Energietransfer verschwënnt.(De Rezeptor ass e Liichtquencher)
2. D'Emissioun ass méi intensiv wéi de Rezeptor selwer, wat zu enger Routverschiebung am sekundäre Fluoreszenzspektrum resultéiert."(Rezeptoren sinn luminéisen Emitteren).
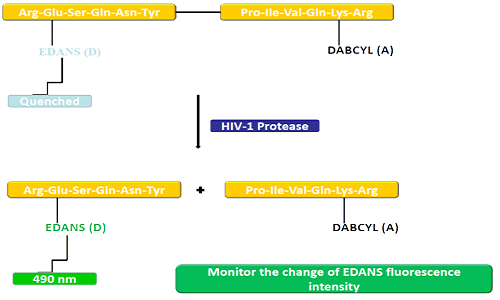
D'Spendergrupp (EDANS) an d'Akzeptorgen (DABCYL) sinn eenheetlech mat dem natierleche Substrat vun der HIV-Protease verbonnen, a wann de Substrat net getrennt ass, kann DABCYL EDANS ausléisen an dann ondetektéierbar fir Fluor ginn.Beim HIV-1 Protease Trennung gëtt EDANS net méi duerch DABCYL geläscht, an EDANS Luciferasen kënnen duerno festgestallt ginn.D'Disponibilitéit vu Protease-Inhibitoren kann duerch Ännerungen an der Fluoreszenzintensitéit vun EDANS iwwerwaacht ginn.
FRET Peptiden si praktesch Tools fir Peptidase Nonspezifizitéit ze studéieren.Well säi Reaktiounsprozess kontinuéierlech iwwerwaacht ka ginn, bitt et eng praktesch Method fir Enzymaktivitéit z'entdecken.De Glanz, deen no der Hydrolyse vu Peptidbindunge vum Spender / Akzeptor produzéiert gëtt, liwwert eng Mooss fir Enzymaktivitéit bei nanomolare Konzentratioune.Wann de FRET-Peptid intakt ass, weist et e plötzlechen Verschwannen vum internen Blitz, awer wann all Peptidbindung vis-à-vis vum Donor / Akzeptor brécht, verëffentlecht et e Blëtz, dee kontinuéierlech erkannt ka ginn an d'Enzymaktivitéit kann dann quantifizéiert ginn.
Post Zäit: Aug-14-2023